গ্লুকোজ হোমিওস্ট্যাসিস নিয়ন্ত্রণে হাইপোথ্যালামাসের ভূমিকা
দেহে গ্লুকোজ সাম্যাবস্থার জন্য অন্ত্ৰীয় ও অন্তঃক্ষরা সঙ্কেতগুলির মিথস্ক্রিয়া মস্তিষ্কের হাইপোথ্যালামাসে পৌঁছানো গুরুত্বপূর্ণ। এর ব্যত্যয় ঘটলে দেখা দিতে পারে টাইপ ২ ডায়াবেটিস-সহ অন্যান্য রোগ।
- প্রকাশ: ০২:১৮:০২ অপরাহ্ন, সোমবার, ১৮ ডিসেম্বর ২০২৩
- / ৫৮১ বার পড়া হয়েছে
আমাদের দেহে গ্লুকোজ হচ্ছে শক্তির একটি প্রধান উৎস। বিশেষ করে মস্তিষ্ক তার শক্তির চাহিদা মেটাতে গ্লুকোজের অবিরাম সরবরাহের উপর নির্ভর করে। সৌভাগ্যবশত, রক্তে গ্লুকোজকে ধ্রুবক স্তরে রাখার জন্য একটি জটিল শারীরবৃত্তীয় ব্যবস্থার উদ্ভব হয়েছে। এই হোমিওস্টেসিস বা সাম্যাবস্থার ব্যত্যয় ঘটলে সৃষ্টি হয় হাইপারগ্লাইসেমিয়া, যা হৃদ-সম্পর্কিত রোগ, নিউরোপ্যাথি এবং নেফ্রোপ্যাথির দিকে পরিচালিত করতে পারে, অথবা রক্তে গ্লুকোজের পরিমাণ কমে গেলে (হাইপোগ্লাইসেমিয়া) দেখা দিতে পারে খিঁচুনি, চেতনা হ্রাস, কোমা, এমনকি মৃত্যুর কারণও হতে পারে।
সমগ্র মানবদেহে আমাদের এন্ডোক্রাইন/অন্তঃক্ষরা সিস্টেমটি হরমোন নিঃসরণ ক’রে শারীরবৃত্তীয় এবং হোমিওস্ট্যাটিক কার্যাবলীর সার্বিক নিয়ন্ত্রণ প্রদান করে। বিশেষায়িত এন্ডোডার্ম-উদ্ভুত অন্ত্ৰীয় এপিথেলীয় কোষ, যা এন্টারোএন্ডোক্রাইন কোষ (EEC)নামে পরিচিত, পুরো অন্ত্রনালি (GI) জুড়ে তাদের বিস্তৃত উপস্থিতি শরীরের বৃহত্তম অন্তঃস্রাবী অঙ্গ গঠন করে, যা অন্ত্ৰীয় নিঃসরণ ও গতিশীলতা নিয়ন্ত্রণে, খাদ্য গ্রহণের নিয়ন্ত্রণ, আহার-পরবর্তী (পোস্টপ্রান্ডিয়াল) গ্লুকোজের মাত্রা এবং বিপাক প্রক্রিয়ায় গুরুত্বপূর্ণ ভূমিকা পালন করে। পৌষ্টিকতন্ত্রের মিউকোসা বরাবর EEC কোষগুলি ২০টিরও বেশি পেপটাইড/হরমোন নিঃসরণ ঘটায়, যাদের মধ্যে অনেকে একাধিক সিগন্যালিং অণু ক্ষরণ করতে পারে।
স্থূল ব্যক্তিদের সংখ্যা বিশ্বব্যাপী বাড়ছে, এবং ডায়াবেটিস, উচ্চ রক্তচাপ, কার্ডিওভাসকুলার রোগ এবং স্লিপ অ্যাপনিয়া সিন্ড্রোমের মতো একাধিক স্থূলতা-সম্পর্কিত রোগীর সংখ্যাও বাড়ছে, যা একটি বড় সমস্যা উভয় সামাজিক এবং অর্থনৈতিকভাবে। মস্তিষ্ক গ্লুকোজ সাম্যাবস্থা নিয়ন্ত্রণে একটি গুরুত্বপূর্ণ ভূমিকা পালন করে। সাম্প্রতিককালের গবেষণা প্রমাণ করে যে, মস্তিষ্কের হাইপোথ্যালামাস অঞ্চলে গ্লুকোজ উপলব্ধি ব্যাহত হওয়া স্থূলতা এবং টাইপ ২ ডায়াবেটিস রোগের একটি সম্ভাব্য কারণ। তাই, রক্তে গ্লুকোজের মাত্রা নিয়ন্ত্রণের জন্য গ্লুকোজ-সেন্সিং প্রক্রিয়া এবং একাধিক ফ্যাক্টর ও প্রতিক্রিয়াশীল সিস্টেমের মধ্যে অত্যন্ত সমন্বিত মিথস্ক্রিয়া অপরিহার্য (Roder et al., 2016)। একটি আঁট পরিসরের মধ্যে গ্লুকোজের মাত্রা বজায় রাখার জন্য হাইপোথ্যালামাস ক্রমাগতভাবে সঞ্চালিত গ্লুকোজের মাত্রা পর্যবেক্ষণ করে এবং অন্ত্ৰীয় কোষগুলির সাথে যথাযথভাবে যোগাযোগ বজায় রাখে। বলা বাহুল্য, হাইপোথ্যালামাস খুব দায়িত্বশীলতার সাথেই এই কাজটি করে।
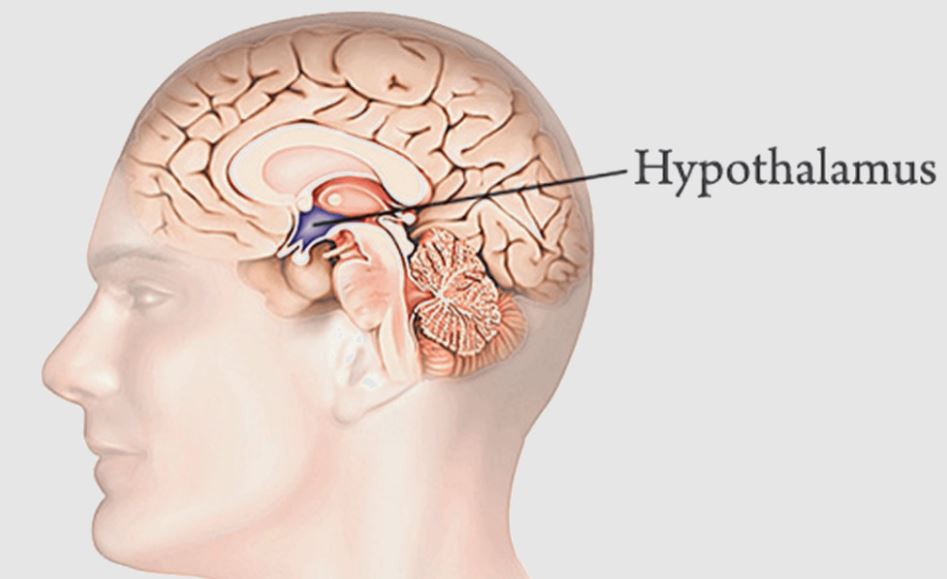
মস্তিষ্কে হাইপোথ্যালামাসের অবস্থান ও গঠন
হাইপোথ্যালামাস হচ্ছে অগ্রমস্তিষ্কের অংশ, যা থ্যালামাসের ঠিক নিচে অবস্থিত, এবং এটি লিম্বিক সিস্টেমের একটি অংশ। দেহের সাম্যাবস্থা (যেমন- তাপমাত্রা, রক্তচাপ ও ক্ষুধা নিয়ন্ত্রণ) বজায় রাখতে হাপোথ্যালামাস মূলত তিন ধরণের কাজের সাথে জড়িত- লিম্বিক ব্যবস্থার নিয়ন্ত্রণ, অন্তঃক্ষরা সিস্টেম এবং অটোনমিক বা স্বয়ংক্রিয় স্নায়ু ব্যবস্থা (সমবেদী ও পরাসমবেদী)-র নিয়ন্ত্রণ। আমার এই নিবন্ধে আহার/ক্ষুধা-নিয়ন্ত্রণ-সহ গ্লুকোজ সাম্যাবস্থার বিষয়টি উল্লেখ করা হয়েছে। হাইপোথ্যালামাস ৯টি স্বতন্ত্র স্নায়ুগুচ্ছ বা নিউক্লিয়াস ধারণ করে, যার মধ্যে আর্কুয়েট নিউক্লিয়াস (ARC), ভেন্ট্রোমিডিয়াল নিউক্লিয়াস (VMN), ডরসোমিডিয়াল নিউক্লিয়াস (DMN), প্যারাভেন্ট্রিকুলার নিউক্লিয়াস (PVN), এবং ল্যাটেরাল নিউক্লিয়াস (LH) এই প্রবন্ধের বিষয়বস্তুর সাথে সম্পর্কিত। এছাড়াও, ব্রেইনস্টেম বা মস্তিস্ক-কাণ্ডের সলিটারি ট্র্যাক্ট নিউক্লিয়াস (NTS/এনটিএস), ভেগাস ডোরসাল মোটর নিউক্লিয়াস (DMNX) এবং রোস্ট্রাল ভেন্ট্রোলেটারাল মেডুলা (RVLM) গ্লুকোজ সংবেদনশীলতার সাথেও জড়িত (দেখুন ছবি ১)। নিউক্লিয়াস হচ্ছে একগুচ্ছ সমজাতীয় অনেকগুলি নিউরনের সমষ্টি। হাইপোথ্যালামাসের সবচেয়ে গুরুত্বপূর্ণ কাজগুলির মধ্যে একটি হলো, এটি (হাইপোফাইসিয়াল ট্র্যাক্ট দ্বারা) পিটুইটারি গ্রন্থির সাথে সংযুক্ত থাকার মাধ্যমে স্নায়ুতন্ত্রের সাথে অন্তঃক্ষরা ব্যবস্থার সংযোগ ঘটায়। হাইপোথ্যালামাস গুরুত্বপূর্ণ কিছু নিউরোপেপটাইড এবং নিউরোট্রান্সমিটার সংশ্লেষণ ও নিঃসরণের মাধ্যমে গ্লুকোজ মাত্রার পরিবর্তনসহ বিভিন্ন বিপাকীয় পরিবর্তনগুলিকে বুঝতে, একীভূত করতে এবং তাৎক্ষণিক প্রতিক্রিয়া করে গ্লুকোজ ও শক্তির সাম্যাবস্থা নিয়ন্ত্রণ করে। এছাড়াও, সাধারণভাবে হাইপোথ্যালামাস শরীরের তাপমাত্রা, মাতৃত্বের সংযুক্তি আচরণ, তৃষ্ণা, ক্লান্তি, ঘুম এবং সির্কাডিয়ান ছন্দ নিয়ন্ত্রণ করে।
হাইপোথ্যালামাস হলো খাদ্য গ্রহণ এবং শক্তি বিপাক নিয়ন্ত্রণের কেন্দ্র। প্রান্তীয় অঙ্গগুলি থেকে যাবতীয় তথ্য রক্তপ্রবাহ (এন্ডোক্রাইন) বা ভেগাস অ্যাফারেন্ট স্নায়ুপথের (প্যারাক্রাইন) মাধ্যমে মধ্যস্থতা করা হয় এবং প্রেরিত হয় হাইপোথ্যালামাসে, যেখানে সংকেতগুলি খাদ্যগ্রহণ-সহ গ্লুকোজ সাম্যাবস্থা এবং অন্যান্য আচরণ নির্ধারণের জন্য বিশ্লেষণ করা হয়। বেশ কিছু ক্ষুধা-নিয়ন্ত্রক (ক্ষুধা-উদ্দীপক এবং ক্ষুধা-সংবাধক) পেপ্টাইড ও হরমোন কেন্দ্রীয় স্নায়ুতন্ত্র এবং অন্ত্র থেকে নিঃসৃত হয়, যা একটি জটিল পদ্ধতিতে দুইয়ের মাঝে যোগাযোগ স্থাপন করে এবং রক্ষিত থাকে গ্লুকোজ সাম্যাবস্থা। অন্ত্ৰীয় পেপ্টাইডগুলি অন্ত্রের মিউকোসা ও সাবমিউকোসা জুড়ে অবস্থিত ভেগাস অ্যাফারেন্ট স্নায়ুপ্রান্তের রিসেপ্টরগুলির সাথে আবদ্ধ হয়ে খাদ্য সংকেতকে ইলেট্রোকেমিক্যাল সঙ্কেতে রূপান্তর করে এবং সলিটারি নিউক্লিয়াস (এনটিএস) হয়ে সংকেতগুলি হাইপোথ্যালামাসে গিয়ে পৌঁছয়। প্রকৃতপক্ষে, ভেগাস স্নায়ু এবং হাইপোথ্যালামাসের মধ্যে একটি সেতুবন্ধ স্থাপন করেছে এনটিএস। ঘ্রেলিন (ghrelin) হরমোন ব্যতীত অন্যান্য সমস্ত অন্ত্ৰীয় পেপ্টাইড সমন্বিতভাবে ভেগাস স্নায়ুর মাধ্যমে হাইপোথ্যালামাসে সংকেত পাঠিয়ে ক্ষুধাকে দমন করে। বিপরীতে, ক্ষুধাবর্ধক পেপ্টাইড, ঘ্রেলিন, ভেগাস নার্ভের মাধ্যমে ক্ষুধা-দমনকারী পেপ্টাইডের ক্রিয়াকে বিরোধিতা করে এবং আহার গ্রহণের চাহিদা বৃদ্বি করে। তবে, আগেও উল্লেখ করেছি, স্নায়বিক পথ ছাড়াও বিকল্প পথে রক্তপ্রবাহের মাধ্যমে EEC-প্রসূত পেপ্টাইড/হরমোনগুলি মস্তিষ্কে অর্থাৎ হাইপোথ্যালামাসে তাদের প্রভাব ফেলতে পারে; তবে, সেটি স্নায়বিক পথের তুলনায় গতিসম্পন্ন পথ নয়; এছাড়া, অনেকক্ষেত্রে রক্ত-মস্তিস্ক প্রতিবন্ধকতা তো রয়েছেই।
ভেগাস স্নায়ুর গঠন ও এর প্রসার
অন্ত্রের উপর যে স্নায়ুর প্রভাব বেশি তার নাম হচ্ছে ভেগাস নার্ভ। পাকস্থলী ও পৌষ্টিকনালি ছাড়াও এই ১০ম করোটিকা স্নায়ুটি হৃদপিণ্ড ও অনেক পেশি, গ্রন্থি, অগ্ন্যাশয় এবং অভ্যন্তরীণ অঙ্গগুলিতে অ্যাফারেন্ট/সংবেদনশীল এবং ইফারেন্ট/মোটর সংকেত বহন করে। ভেগাস স্নায়ু সিস্টেমের ৮০% হচ্ছে অ্যাফারেন্ট এবং ২০% হচ্ছে ইফারেন্ট প্রকৃতির। এটি মস্তিষ্ক-কাণ্ড (ব্রেইনস্টেম) থেকে, ঘাড় এবং বক্ষের মধ্য দিয়ে উদর পর্যন্ত প্রসারিত। আন্তঃক্রিয়ামূলক সচেতনতায় এর কার্যকারিতার কারণে এটি ষষ্ঠ ইন্দ্রিয় হিসেবেও বিবেচিত হয়। এটি পরাসমবেদী স্নায়ুতন্ত্রের প্রধান অবদানকারী একটি স্নায়ু এবং মস্তিষ্ক ও শরীরের মধ্যে একটি প্রাথমিক যোগাযোগের পথ। বলে রাখা ভালো, ভেগাস স্নায়ুটি সলিটারি নিউক্লিয়াস অবধি এসে শেষ হয়ে যায়, এবং সেখান থেকে ভিন্ন স্নায়ুপথে অন্ত্ৰীয়-তথ্যগুলি হাইপোথ্যালামাসে গিয়ে পৌঁছয় (দেখুন ছবি ২)। অর্থাৎ, এনটিএস-কে একটি রেল-জংশন হিসেবে তুলনা করা যায়, যেখানে আরও তিনটি ভিন্ন নিউক্লিয়াসের সাথে ভেগাস নার্ভটির নিউক্লিয়াস (ডর্সাল মোটর নিউক্লিয়াস) অবস্থিত। তাই, ভেগাস অ্যাফারেন্ট স্নায়ুটি দেহের প্রান্তীয় তথ্যসমূহ নোডস গ্যাংলিয়ন (nodose ganglion) হয়ে প্রাথমিকভাবে একীভূত হয় মস্তিস্ক-কাণ্ডের সলিটারি নিউক্লিয়াসে এবং সেখান থেকে নির্দিষ্ট স্নায়ুর মাধ্যমে আহার/ক্ষুধা ও গ্লুকোজ-সম্পর্কিত তথ্য গিয়ে পৌঁছয় ল্যাটেরাল প্যারাব্রাকিয়াল নিউক্লিয়াস (LPBN), পেরিভেন্ট্রিকুলার নিউক্লিয়াস এবং ল্যাটেরাল হাইপোথ্যালামাসে এবং অ্যামিগডালা-য়, যা একটি কেন্দ্রীয় অটোনমিক নেটওয়ার্ক গঠন করে (দেখুন ছবি ২)।
এছাড়াও অন্ত্ৰীয় নার্ভাস সিস্টেম (ENS)নামে অন্ত্রে নিজস্ব কিছু স্নায়ুগুচ্ছ আছে (যা শরীরের দ্বিতীয় মস্তিষ্ক বলে অভিহিত), যা ভেগাস স্নায়ুকে নানা তথ্য দিয়েও উদ্দীপিত করতে পারে। এই নিউরনগুলি কেন্দ্রীয় স্নায়ুতন্ত্রের মতো, কেন্দ্রীয় স্নায়ুতন্ত্রের (ভেগাস নার্ভ) প্রভাব ছাড়াই, স্বতন্ত্রভাবে নিজেদের মধ্যে নিউরোট্রান্সমিটার (অ্যাসিটিলকোলিন, ডোপামিন এবং সেরোটোনিন) নিঃসরণের মাধ্যমে যোগাযোগ করে। উপরন্তু, (অগ্ন্যাশয়ের অটোনমিক নার্ভ-সংস্থান ছাড়াও) ইন্সুলিন ক্ষরণের জন্য অন্ত্ৰীয় নিউরন সিস্টেম থেকে সরাসরি নার্ভিয় যোগাযোগ রয়েছে অগ্ন্যাশয়ে, যেক্ষেত্রে প্রক্ষিপ্ত অন্ত্রের তন্তুসমূহ সম্ভবত নিঃসরণ ঘটায় সেরোটোনিন ও অ্যাসিটিলকোলিন।
এন্টেরোএন্ডোক্রাইন ব্যবস্থা এবং গ্লুকোজ সংবেদনশীলতা
সমস্ত অমেরুদন্ডী ও মেরুদন্ডী প্রাণিদের পরিপাকনালি খাদ্য বিপাক এবং পুষ্টি শোষণের প্রধান স্থান হিসেবে কাজ করে। এই সংস্থানটি নানা ধরনের কোষ নিয়ে গঠিত এবং এই কোষগুলি অন্ত্ৰীয় এপিথেলিয়ামের মাত্র ১% প্রতিনিধিত্ব করে। এন্টারোএন্ডোক্রাইন কোষ (EEC)গুলি হচ্ছে অন্ত্র-মস্তিষ্ক অক্ষের বিশেষ সংবেদনশীল অন্তঃস্রাবী কোষ, যা অন্ত্রের এপিথেলিয়াম বরাবর বিক্ষিপ্তভাবে ছড়িয়ে আছে (দেখুন ছবি ৩)। অন্ত্রীয় স্টেম সেল (intestinal stem cells) থেকে উদ্ভুত এই কোষগুলি পরিপাকতন্ত্রের, পাকস্থলী থেকে ইলিয়াম পর্যন্ত ভিলাই(villi)গুলির ভাঁজে-ভাঁজে একক কোষ হিসেবে ছড়িয়ে ছিটিয়ে আছে, যেখানে তারা অন্ত্রের বিভিন্ন পরিবেশগত উদ্দীপনাকে অনুধাবন করতে সক্ষম। এক অর্থে তারা কেমোরেসেপ্টর হিসেবে কাজ করে। ফলস্বরূপ, উদ্দীপনার প্রতিক্রিয়া হিসেবে এবং বিভিন্ন জৈবিক ও শারীরবৃত্তীয় প্রক্রিয়া নিয়ন্ত্রণ করতে এই কোষগুলি নানা জাতীয় নিউরোপেপটাইড ও হরমোন নিঃসরণ করে। স্তন্যপায়ী প্রাণিদের মধ্যে এ-জাতীয় মোট ১২ ধরনের অন্তঃস্রাবী কোষ শনাক্ত হয়েছে, যেমন এন্টারোক্রোমাফিন-সদৃশ (ECL) কোষ, G-কোষ, I-কোষ, K-কোষ, L-কোষ ইত্যাদি, এবং শেষোক্ত তিন ধরনের কোষ এই প্রবন্ধের বিষয়বস্তুর সাথে সম্পর্কিত। বিপাক ও শোষণের প্রধান অঞ্চল ক্ষুদ্রান্ত্র (ডেডুনাম ও জেজুনাম),ইলিয়াম এবং কোলনে I- এবং L-কোষগুলি বেশি পাওয়া যায়, যেখানে তারা ক্ষুধা নিয়ন্ত্রণ এবং গ্লুকোজ সাম্যাবস্থার জন্য যথাক্রমে নিঃসরণ করে কোলেসিস্টোকাইনিন (CCK) এবং গ্লুকোজ-নির্ভর ইনসুলিনোট্রপিক পলিপেপ্টাইড (GIP/জিআইপি) ও গ্লুকাগন-সদৃশ পেপটাইড-1 (জিএলপি-১) (দেখুন ছবি ৩)। শেষোক্ত দুটি পেপ্টাইড ইনক্রিটিন গ্রুপের হরমোন।
সিস্টেমিক প্রভাব তৈরি করতে হরমোনগুলি রক্ত প্রবাহে নির্গত হতে পারে (এন্ডোক্রাইন) বা প্যারাক্রাইন বার্তাবাহক হিসেবে স্থানীয়ভাবে তাদের প্রভাব ফেলতে পারে, কিংবা স্নায়বিক প্রতিক্রিয়া সক্রিয় করতে এন্টারিক স্নায়ুতন্ত্রে প্রেরণ করতে করে। অন্ত্রের হরমোন/পেপ্টাইড নিঃসরণকারী EEC ছাড়াও, একধরনের বিশেষায়িত এন্টারোএন্ডোক্রাইন কোষের (এই কোষগুলিকে “নিউরোপড” বলা হয়) উপস্থিতি আবিষ্কৃত হয়েছে, যা অন্ত্র জুড়ে ছুঁয়ে যাওয়া ভেগাস অ্যাফারেন্ট নিউরনগুলির সাথে সরাসরি সংযোগ স্থাপন করে এবং গ্লুটামেট নিউরোট্রান্সমিটার মুক্ত ক’রে (উপরিল্লিখিত পেপ্টাইডগুলির নিঃসরণের পূর্বেই) মেকানোরিসেপ্টর-অনুভূত পাকস্থলীর স্ফীতি এবং অন্ত্রে গ্লুকোজ ও অন্যান্য খাদ্যকণার উপস্থিতি-সহ প্রয়োজনীয় তথ্য দ্রুত (মিলিসেকেন্ড সময়ে) মস্তিষ্কের হাইপোথ্যালামাসে প্রেরণ করে। হাইপোথ্যালামাস খাদ্য গ্রহণ, শক্তি ব্যয় এবং গ্লুকোজ সাম্যাবস্থা নিয়ন্ত্রণের জন্য অন্ত্র থেকে প্রাপ্ত ওই সঙ্কেতগুলিকে একীভূত করে এবং দ্রুত বিশ্লেষণ করে (Schwartz et al., 2000; Lam et al., 2009)। “ভ্যাগো-ভ্যাগাল রিফ্লেক্স”-এর মাধ্যমে হাইপোথ্যালামাস নির্নিমেষে ইন্সুলিন সংশ্লেষণ ও ক্ষরণের জন্য অগ্ন্যাশয়েরবিটা-কোষে অ্যাসিটিলকোলিন নিউরোট্রান্সমিটারের মাধ্যমে বার্তা পাঠায়। বিপরীতে, হাইপোথ্যালামাস বার্তা পাঠায় অগ্ন্যাশয়ের আল্ফ়া-কোষগুলিকে গ্লুকাগন নিঃসরণের জন্য, যা ইন্সুলিনের ক্ষরণকে বাধা দেয়।
গ্লুকাগন-সদৃশ পেপটাইড-১ (জিএলপি-১)
অন্ত্রের লুমেন (lumen) থেকে গ্লুকোজ মূলত শোষিত হয় এন্টারোসাইট (enterocytes)গুলিতে এপিক্যাল ঝিল্লির Na+/গ্লুকোজ কোট্রান্সপোর্টার (SGLT1)-এর মাধ্যমে, যদিও গ্লুকোজ ট্রান্সপোর্টার টাইপ ২ (GLUT2) গ্লুকোজ পরিবহনে ভূমিকা রাখতে পারে। তবে, ব্যাপন প্রক্রিয়ার মাধ্যমে এন্টেরোসাইটের ব্যাসোল্যাটেরাল ঝিল্লিবদ্ধ GLUT2-পরিবাহীর মাধ্যমে গ্লুকোজ নির্গমন করে রক্তপ্রবাহে। এছাড়াও, গ্লুকোজ-উদ্দীপিত জিএলপি-১ নিঃসরণের জন্য L-কোষে গ্লুকোজ ও সাথে সোডিয়াম প্রবেশ করে SGLT1 দ্বারা। ফলস্বরূপ, কোষাভ্যন্তরে পটাশিয়াম, ক্যালসিয়াম ও cAMP অণুর পরিমাণ বৃদ্ধি পায়, পরিবর্তিত হয় কোষটির আধানগত অবস্থা (ডিপোলারাইজেশন), যখন প্রতিক্রিয়া হিসেবে “L-কোষ” থেকে নিঃসৃত হয় জিএলপি-১ (Wachsmuth et al., 2022)। এছাড়া, ফ্যাটি অ্যাসিড বা অ্যামিনো অ্যাসিড খাদ্যকণা-উদ্দীপনার মাধমেও নিঃসৃত হতে পারে জিএলপি-১। L-কোষ থেকে নিঃসৃত হয় আরও একটি পেপ্টাইড PYY। খাদ্য গ্রহণের প্রতিক্রিয়ায় এর নিঃসরণ দ্রুত বৃদ্ধি পায় এবং এটি ক্ষুধা হ্রাস করে (দেখুন ছবি ৪)।
ইনক্রিটিন (incretin) হরমোন হিসেবে জিএলপি-১-এর প্রধান লক্ষ্য হলো ইনসুলিন নিঃসরণ করা এবং গ্লুকাগন নিঃসরণকে বাধা দেওয়া। পূর্বসূরি প্রি-প্রোগ্লুকাগন (pre-proglucagon) থেকে তৈরি হয় গ্লুকাগন ও জিএলপি-১-সহ অনেক হরমোন। যেহেতু তারা একই উৎস থেকে আসে এবং এই হরমোনগুলির মাঝে কিছু মিলও রয়েছে, তাই জিএলপি-কে “গ্লুকাগন-সদৃশ”পেপ্টাইড বলা হয়। ক্ষুদ্রান্ত্রের “এল-কোষ”জিএলপি-১ নিঃসরণের প্রধান উৎস হলেও, এটি অগ্ন্যাশয় (আল্ফ়া-কোষ) এবং কেন্দ্রীয় স্নায়ুতন্ত্র (মস্তিস্ক-কাণ্ড/এনটিএস) থেকেও নিঃসৃত হয় এবং অগ্ন্যাশয়ের বিটা-কোষে জিএলপি-১-রিসেপ্টর বিদ্যমান। মস্তিষ্কে, মস্তিস্ক-কাণ্ডের এনটিএস হচ্ছে জিএলপি-১ সংশ্লেষণের প্রধান উৎস। জিএলপি-১-এর মাত্রা নিয়ন্ত্রণ করে মূলত দুটি প্রোটিন- সোমাটোস্ট্যাটিন হরমোন জিএলপি১-এর উৎপাদনকে হ্রাস করে এবং ডাইপেপ্টিডিল পেপ্টিডেজ-৪ (DPP-4) এনজাইমটি জিএলপি১-কে ভেঙে ফেলে। তাই, সংশ্লেষিত জিএলপি-১ পেপ্টাইডটি খুব ক্ষণস্থায়ী, যার অর্ধেক-আয়ুষ্কাল মাত্র ১-২ মিনিট। এটি স্বল্প আয়ুর একটি প্রোটিন হলেও এর প্রভাব সুদূর বিস্তৃত। জিএলপি-১ তার প্রভাব ফেলে জিএলপি-১-রিসেপ্টরের মাধ্যমে।
মস্তিষ্কে অনুকূল পরিবেশ বজায় রাখতে রক্ত-মস্তিষ্ক প্রতিবন্ধক (Blood-brain barrier, BBB) একটি গুরুত্বপূর্ণ ভূমিকা পালন করে। যেহেতু BBB/বিবিবি সেরিব্রাল রক্তনালি এবং সেরিব্রাল কোষের মধ্যে পদার্থের বিনিময় নিয়ন্ত্রণ করে, তাই অন্ত্রের হরমোন সাধারণত মস্তিষ্কে প্রবেশ করে না। তবে, হাইপোথ্যালামাস, পিটুইটারি গ্রন্থি, মেডুলা অবলংগাটা এবং অন্যান্য সার্কামভেন্ট্রিকুলার অঙ্গগুলিতে, সেরিব্রাল কর্টেক্সের তুলনায় বিবিবি অনেকটা শিথিলযোগ্য বলে রক্তনালিতে উপস্থিত অন্ত্রের হরমোনগুলি সম্ভবত মস্তিষ্কের ওইসব অঙ্গে প্রবেশ করার সম্ভাবনা রাখে (Chaudhri et al., 2008)। এইভাবে, অন্ত্রের হরমোনগুলি সরাসরি হাইপোথ্যালামাসে পৌঁছানোর সম্ভাবনা রয়ে গেছে। অধিকন্তু, হাইপোথালামাসের LH, PVN, DMN, ARC নিউরনগুলিতে এবং মস্তিস্ক-কাণ্ডের NTS ও AP (এরিয়া পোস্ট্রেমা) নিউরনগুলিতেও জিএলপি-১-রিসেপ্টর বিদ্যমান। এছাড়াও, অগ্নাশয়ের বিটা-কোষপৃষ্ঠে GLP1R প্রকাশ পায়।
টাইপ ২ ডায়াবেটিসে গ্লুকোজের মাত্রা নিয়ন্ত্রণে জিএলপি-১ পেপ্টাইডের ভূমিকা অনন্য। গ্লুকোজ ছাড়াও, দীর্ঘ চেইন ফ্যাটি অ্যাসিড, অ্যামিনো অ্যাসিড এবং ভেগাস ও অন্ত্ৰীয় নিউরনে প্রকাশিত নিউরোট্রান্সমিটার, যেমন অ্যাসিটিলকোলিন (ACh) ও গ্যাস্ট্রিন-রিলিসিং পেপটাইড (GRP) তাদের নিজস্ব রিসেপ্টরের প্রভাবে জিএলপি-১ পেপ্টাইডের নিঃসরণ বাড়ায়। অগ্নাশয়ের বিটা-কোষে জিএলপি-১ লাইগান্ড জিএলপি-১ রিসেপ্টরকে উদ্দীপিত করে। ফলে, এনজাইম অ্যাডিনাইলেট সাইক্লেজ সক্রিয় হয়ে প্রচুর পরিমানে cAMP উৎপন্ন করে, যার মধ্যস্থতায় প্রোটিন কাইনেজ এ (PKA) ও গুয়ানিন নিউক্লিওটাইড এক্সচেঞ্জ ফ্যাক্টর (EPAC2) সংকেতপথ-দুটি উদ্দীপিত হয়। ফলশ্রুতিতে, বিটা-কোষপৃষ্ঠের পটাশিয়াম (KATP) ও ভোল্টেজ-নির্ভর ক্যালসিয়াম চ্যানেল (VDCC)গুলির নিয়ন্ত্রণে কোষাভ্যন্তরে ক্যালসিয়ামের পরিমান বৃদ্ধি পায়। কোষটি অর্জন করে ডিপোলারাইজেশন (ধনাত্মক আধানের পরিবেশ) এবং এক্সোসাইটোসিস প্রক্রিয়ায় কোষ থেকে মুক্তি পায় ইন্সুলিন।
জিএলপি-১ ছাড়াও, “K”-গ্রুপের এন্টারোএন্ডোক্রাইন কোষ থেকে নিঃসৃত GIP (গ্লুকোজ-নির্ভর ইনসুলিনোট্রপিক পলিপেপটাইড, জিআইপি) হরমোনটিও রক্তের গ্লুকোজ নিয়ন্ত্রণে অগ্ন্যাশয়ে ইনসুলিন ক্ষরণে ভূমিকা পালন করে। জিআইপি রিসেপ্টর (GIPR) অগ্ন্যাশয়ের বিটা-কোষ ছাড়াও, হাইপোথ্যালামাসের আর্কুয়েট নিউক্লিয়াস, ডরসোমেডিয়াল নিউক্লিয়াস এবং প্যারাভেন্ট্রিকুলার নিউক্লিয়াসের নিউরনগুলিতে পাওয়া যায়। সম্ভবত, খাদ্য গ্রহণের উপর প্রভাব ফেলতে জিআইপি একটি অন্তঃস্রাবী ফ্যাশনে কাজ করতে পারে। তবে এটা প্রমাণিত যে, মানব এডিপোজ টিস্যুতে চর্বি সঞ্চয় করতে এই হরমোনটির ভুমিকা রয়েছে এবং এটি স্থূলতার কারণ হিসেবেও চিহ্নিত (Fukuda et al., 2021)। টাইপ ২ ডায়াবেটিস নিয়ন্ত্রণে এককভাবে এর সরাসরি সম্পৃক্ততার প্রমাণ না থাকলেও, একটি সাম্প্রতিক গবেষণায় প্রমাণ মিলেছে যে, যুগল জিএলপি-১ এবং জিআইপি রিসেপ্টর অ্যাগোনিস্ট সফলতার সাথে গ্লাইসেমিক নিয়ন্ত্রণ, ইনসুলিন সংবেদনশীলতা, লিপিড বিপাক এবং শরীরের ওজন হ্রাস করতে সক্ষম হয়েছে (Jastreboff etal., 2022)।
কোলেসিস্টোকাইনিন (Cholecystokinin)
এন্টারোএন্ডোক্রাইন কোষ থেকে প্রসূত কোলেসিস্টোকাইনিন (CCK/সিসিকে) প্রোটিন একটি আহার-পরিতৃপ্তিমূলক ফ্যাক্টর হিসেবে সর্বজনীনভাবে গৃহীত। এটি পেপ্টাইড হরমোনের গ্যাস্ট্রিন/কোলেসিস্টোকাইনিন পরিবারের একটি সদস্য এবং গঠনগত দিক থেকে গ্যাস্ট্রিন হরমোনের সাথে অনেকটা একই রকম। আই-কোষ (I-cells) সেধরনের এন্টারোএন্ডোক্রাইন কোষগুলির একটি সাবটাইপ, যা ক্ষুদ্রান্ত্রের ডুডেনামে ভুক্ত আহার্যাংশ, বিশেষকরে অ্যামিনো অ্যাসিড, ছোট পেপ্টাইড এবং ফ্যাটি অ্যাসিডের উপস্থিতিতে কোলেসিস্টোকাইনিন নিঃসরণ ঘটায় ও মুক্ত করে। CCK8/CCK58 হলো পরিপাকতন্ত্রের প্রোটিন, যা পিত্তস্থলীর সংকোচন বৃদ্ধি ছাড়াও পিত্তরস ও অগ্ন্যাশয়ের (এনজাইম) ক্ষরণ নিঃসরণ বাড়িয়ে হজম প্রক্রিয়া সহজতর করে। এটি অগ্ন্যাশয় থেকে ক্ষরণ যথেষ্ট বাড়ায় বলে কোলেসিস্টোকাইনিনকে একসময়ে প্যানক্রিওজাইমিন (pancreozymin) নামেও অভিহিত করা হয়েছিল। সর্বোপরি, এটি স্বল্পমেয়াদে (খাদ্যগ্রহণের) পূর্ণতার সংবেদন বাড়িয়ে মস্তিষ্কের ক্ষুধা কেন্দ্রগুলিকে প্রভাবিত করার পাশাপাশি ক্ষুধাকে দমন করে; সাথে, অতিরিক্ত খাওয়া ও ওজন বৃদ্ধি সীমিত রাখে। বিপাক শেষে এর নিঃসরণ হ্রাস পায় সোমাটোস্ট্যাটিন হরমোন ও প্যানক্রিয়াটিক পেপ্টাইড দ্বারা।
কোলেসিস্টোকাইনিন পুরো অন্ত্র জুড়ে এবং মস্তিষ্কের বিশেষ কিছু অংশে দুই ধরনের (CCK1R, CCK2R) রিসেপ্টরের উপর কাজ ক’রে আহার-সংক্রান্ত তৃপ্তির মধ্যস্থতা করে। জি প্রোটিন-সংযুক্ত এই রিসেপ্টরগুলি পাওয়া যায় পিত্তস্থলীর পেশি, পাকস্থলী ও অন্ত্রের মিউকোসা আস্তরণ, অগ্ন্যাশয়ের কোষপৃষ্ঠে, অন্ত্ৰীয় ভ্যাগাল অ্যাফারেন্ট নিউরনে, ডোরসাল ভ্যাগাল কমপ্লেক্স (নিউক্লিয়াস ট্র্যাক্টাস সোলিটারি, ডোরসাল মোটর নিউক্লিয়াস ও এরিয়া পোস্ট্রেমা) এবং মস্তিষ্কের হাইপোথ্যালামাসে। এছাড়াও, সিসিকে-নিঃসরণের স্নায়বিক উদ্দীপক হিসেবে কাজ করে পরাসমবেদী স্নায়ু ভেগাস থেকে নিঃসৃত অ্যাসিটিলকোলিন। সিসিকে মস্তিস্ক (সেরিব্রাল কর্টেক্স, থ্যালামাস, হাইপোথ্যালামাস) থেকেও সংশেষিত হয়, যেখানে এটি একটি নিউরোট্রান্সমিটার হিসেবে কাজ করে। কোলেসিস্টোকাইনিন কেন্দ্রীয় স্নায়ুতন্ত্রের নিউরোপেপ্টাইড এবং অন্ত্রে পেপ্টাইড হরমোন হিসেবে উভয়ই গুরুত্বপূর্ণ শারীরবৃত্তীয় ভূমিকা পালন করে। সিসিকে বিপাক, তৃপ্তি এবং উদ্বেগের মতো বেশ কয়েকটি প্রক্রিয়ায় অংশগ্রহণ করে। পেপ্টাইড হরমোন হিসেবে, সিসিকে কেন্দ্রীয় স্নায়ুতন্ত্র জুড়ে ব্যাপকভাবে উপস্থিত সিসিকে রিসেপ্টরগুলির উপর কাজ ক’রে তৃপ্তির মধ্যস্থতা করে। দেখা গেছে, সিসিকে ভেগাস সংবেদনশীল নিউরনে প্যারাক্রাইন এবং ডোরসাল ভ্যাগাল কমপ্লেক্সের উভয় ক্রিয়াগুলির মাধ্যমে তার কার্য সম্পাদন করতে পারে (Travagli et al., 2016)। কোলেসিস্টোকাইনিন ও ঘ্রেলিন (ghrelin) দুটি বিপরীতধর্মী অন্তঃস্রাবী হরমোন, যেখানে শেষোক্ত হরমোনটি খাদ্য গ্রহণের উদ্দীপক হিসেবে কাজ করে। কোলেসিস্টোকাইনিন ও ঘ্রেলিন উভয়ই গ্লুকোজ সাম্যাবস্থা বজায় রাখতেও গুরুত্বপূর্ণ ভূমিকা পালন করে।
হাইপোথ্যালামাস ও গ্লুকোজ হোমিওস্ট্যাসিস
দেহে আহারের সাম্যাবস্থা রাখতে হাইপোথ্যালামাস হলো প্রধান নিয়ন্ত্রক, যেখানে ক্ষুধা এবং তৃপ্তি সংক্রান্ত সংকেত আহারের আগ্রহ এবং খাদ্যগ্রহণকেও প্রভাবিত করে। অন্ত্রের সাথে হাইপোথ্যালামাসের এই জটিল এবং অত্যন্ত সমন্বিত ফাংশনটি নিয়ন্ত্রণ করে স্বয়ংক্রিয় বা অনৈচ্ছিক স্নায়ুতন্ত্র (সমবেদী এবং পরাসমবেদী) এবং অন্ত্রের অন্তঃস্রাবী সিস্টেম। আহার-সংক্রান্ত সঙ্কেতগুলি প্রাথমিকভাবে উত্থিত হয় অন্ত্রে গ্লুকোজ, পেপ্টাইড, ফ্যাটি অ্যাসিড ইত্যাদির উপস্থিতিতে। প্লাজমায় গ্লুকোজ সাম্যাবস্থা বজায় রাখা অত্যন্ত গুরুত্বপূর্ণ। ফলস্বরুপঃ অন্ত্র এবং হাইপোথ্যালামাসের মধ্যে অন্তঃক্ষরা (হরমোন-পরিচালিত) সংকেত এবং ভেগাস নার্ভের মাধ্যমে একটি যোগাযোগ মধ্যস্থতা করা হয়। ভেগাস স্নায়ুটি পৌষ্টিকতন্ত্র থেকে মস্তিস্ক-কাণ্ডের এনটিএস পর্যন্ত প্রসারিত, যেখানে ভেগাস-নিঃসৃত গ্লুটামেট উদ্দীপিত করে এনটিএস এলাকার যাবতীয় নিউরনকে। এর ধারাবাহিকতায় NTS নিউরনগুলি মুক্ত করে গ্লুটামেট, গামা-অ্যামিনোবুটারিক অ্যাসিড (GABA), নরএপিনেফ্রিন, জিএলপি-১ এবং সিসিকে (Andermann M, Lowell B, 2017)। এনটিএস থেকে NTSGLP1– এবং NTSCCK-স্নায়ুতন্তুগুলি (যা আহার-সংক্রান্ত পরিতৃপ্তি এবং গ্লুকোজ সাম্যাবস্থার সাথে জড়িত) মস্তিষ্কের ল্যাটেরাল প্যারাব্রাকিয়াল নিউক্লিয়াস (মধ্যমস্তিস্ক ও পন্স এর মাঝামাঝি অবস্থিত), হাইপোথ্যালামাসের আর্কুয়েট নিউক্লিয়াস, ল্যাটেরাল নিউক্লিয়াস এবং অ্যামিগডালা-য় পৌঁছয়। হাইপোথ্যালামাসে দুই ধরনের গ্লুকোজ-সংবেদী নিউরন রয়েছে: গ্লুকোজ-উদ্দীপক এবং গ্লুকোজ-সংবাধক নিউরন। রক্তে গ্লুকোজের মাত্রা বৃদ্ধি পেলে গ্লুকোজ-উদ্দীপ্ত নিউরনগুলি সক্রিয় হয়; বিপরীতে, হাইপোগ্লাইসেমিক অবস্থার কারণে গ্লুকোজ-নিরোধোক নিউরনগুলি সক্রিয় হয় (Routh et al., 2010)। আর্কুয়েট নিউক্লিয়াস হচ্ছে আহার নিয়ন্ত্রণ ও গ্লুকোজের স্তর সমবস্থায় রাখার প্রধান কেন্দ্র এবং এটি অবস্থানগত দিক থেকেও একটি সুবিধাজনক জায়গায় রয়েছে, যা ভেগাস-এনটিএস-পরিবাহিত প্যারাক্রাইন সংকেত ছাড়াও খুব দ্রুত রক্তপ্রবাহ থেকেও অন্ত্ৰীয় হরমোন (লেপ্টিন, জিএলপি-১, সিসিকে বা ঘ্রেলিন)-সংশ্লিষ্ট সংকেত গ্রহণ করতে পারে। এছাড়াও, ARC পুরো শরীরের শক্তির অবস্থা অনুধাবনে একটি মৌলিক ভূমিকা পালন করে।
আর্কুয়েট নিউক্লিয়াসে দুটি নিউরনগোষ্ঠী রয়েছে, যারা দুটি বিপরীতধর্মী পেপ্টাইড- নিউরোপেপ্টাইড ওয়াই (NPY)/আগাউটি-সম্পর্কিত প্রোটিন (AgRP) এবং প্রো-অপিওমেলানোকোর্টিন (POMC)- নিঃসরণের মাধ্যমে গ্লুকোজ সাম্যাবস্থা নিয়ন্ত্রণ করে (Yang et al., 2022)। যখন রক্তে গ্লুকোজের মাত্রা বৃদ্ধি পায়, তখন POMC-নিউরনগোষ্ঠী থেকে সংশ্লেষিত α-MSH (মেলানোসাইট উদ্দীপক হরমোন) মেলানোকোর্টিন রিসেপ্টর (MC4R)এর মাধ্যমে সক্রিয় করে ভেন্ট্রোমিডিয়াল নিউক্লিয়াস (VMN)কে এবং যার উদ্দীপনে সৃষ্টি হয় একটি অ্যানোরেক্সিজেনিক প্রভাব, যা অন্ত্ৰীয় গ্লুকোজ-বিপাক নিয়ন্ত্রণে ভূমিকা রাখে (Schwartz et al., 2000); সাথে কর্টিকোট্রোপিন-রিলিসিং হরমোন (CRH) নিঃসরণের মাধ্যমে আহারের পরিপূর্ণতা অনুভব করে এবং আহারকে দমন করে। পক্ষান্তরে, যখন রক্তে গ্লুকোজের মাত্রা কমে যায়, আর্কুয়েট নিউক্লিয়াসের ভিন্ন একটি নিউরনগোষ্ঠী (NPY/AgRP নিউরন) নিঃসরণ ঘটায় গামা-অ্যামিনোবুটারিক অ্যাসিড (GABA) এবং দুটি নিউরোপেপ্টাইড, NPY ও AgRP। GABA সঙ্কেত বাধা দেয় POMC নিউরোনাল ক্রিয়াকলাপকে, ফলে α-MSH নিঃসরণ বাধাগ্রস্ত হয়। NPY/AgRP সক্রিয় করে ল্যাটেরাল নিউক্লিয়াসকে এবং মুক্ত করে ওরেক্সিন (orexin)-নামক একটি ক্ষুধাবর্ধক হরমোন, যা আহারের আগ্রহ, খাদ্যগ্রহণ বৃদ্ধি করে এবং ফিরিয়ে আনে রক্তে গ্লুকোজ-মাত্রার সমঅবস্থা। বলা বাহুল্য, এন্ডোক্রাইন ও প্যারাক্রাইন (স্নায়বিক) উভয় পথে এডিপোজ টিস্যু থেকে নিঃসৃত লেপ্টিন, অগ্ন্যাশয় থেকে নিঃসৃত ইন্সুলিন এবং পাকস্থলী-প্রসূত ঘ্রেলিন হরমোনগুলিও বিপরীত প্রতিক্রিয়ায় আহার দমন ও আহার গ্রহণের প্রভাব ফেলে আর্কুয়েট নিউক্লিয়াসে, তথা VMN ও LH নিউক্লিয়াসদ্বয়ে তাদের নিজস্ব রিসেপ্টরের মাধ্যমে।
হাইপোথ্যালামাস এবং ডায়াবেটিস
সাম্প্রতিক বছরগুলিতে হাইপোথ্যালামাস এবং ডায়াবেটিসের মধ্যে কোনো সংযোগ আছে কিনা, তা জানার জন্য নতুন করে আগ্রহ তৈরি হয়েছে। এটি এখন অনেকটাই স্বীকৃত যে হাইপোথ্যালামাসে একটি প্রদাহজনক প্রতিক্রিয়া বিপাকীয় সিন্ড্রোম বা টাইপ ২ ডায়াবেটিসের কারণ হতে পারে। কোষাভ্যন্তরে ইন্সুলিন-প্ররোচিত সঙ্কেতসংবহনে ইন্সুলিন রিসেপ্টর সাবস্ট্রেট (IRS1/2) প্রোটিনটির গুরুত্বপূর্ণ ভূমিকা রয়েছে (Brady M, 2004; Withers et al., 1998)। এটি একটি অন্তঃকোষীয় অ্যাডাপ্টার প্রোটিন, যা উদ্দীপ্ত ইনসুলিন রিসেপ্টর (Ins-R) এর সাথে আবদ্ধ হয়ে সক্রিয়তা অর্জন করে এবং সক্রিয় করে তোলে কোষের ফসফোইনোসিটাইড ৩-কাইনেজ (PI3K) ও প্রোটিন কাইনেজ বি (PKB/Akt)-পরিচালিত অন্তঃকোষীয় সংকেত সংবহনকে। কোষাভ্যন্তরে PKB প্রোটিনটি গ্লুকোজের আগমনকে সহজতর করার জন্য গ্লুকোজ ট্রান্সপোর্টার (GLUT4) বাহককে কোষঝিল্লিতে তার একটি নির্দিষ্টি অবস্থান তৈরি করে দেয়। গ্লুকোজ আকারে যেহেতু বড়, তাই সে ঝিল্লিভেদ্য অণু নয়, তার প্রয়োজন একটি বাহক, অর্থাৎ GLUT4 প্রোটিন। এভাবেই ইন্সুলিন তার রিসেপ্টরের সাথে আবদ্ধ হয়ে তার লক্ষ্যকে অর্জন করে। হাইপোথ্যালামাসের যে দুটি অঞ্চল (ARC এবং PVN) শরীরের শক্তি এবং গ্লুকোজ সাম্যাবস্থা নিয়ন্ত্রণ করে, সেই স্নায়ুকোষগুলিতে IRS2 ব্যাপকভাবে প্রকাশ পায়, এবং গবেষণায় দেখা গেছে যে, ওই কোষগুলিতে IRS2 এর ঘাটতি হাইপোথ্যালামাস প্রদাহের বড় একটি কারণ, ফলে অগ্ন্যাশয়ে আইলেটের ভর ৪০-৪৫% হ্রাস পেয়ে যায় (Tao et al., 2019)। অন্যথায়, প্রদাহজনিত কারণে IRS প্রোটিনের কার্যক্ষমতা লাঘব হলে গ্লুকোজ তার গন্তব্যে অর্থাৎ কোষাভ্যন্তরে পৌঁছয় না। ফলে, রক্তে গ্লুকোজের পরিমাণ বেড়ে যায় এবং ডায়াবেটিস-সহ উচ্চ রক্তচাপের সৃষ্টি হয়। এছাড়াও দেখা গেছে, হাইপোথ্যালামাসের নিউরনগুলিতে বিপাকীয় প্রদাহের মূল কারণ হিসেবে IKK-β/NF-kB পাথওয়ে- এই দুটি প্রোইনফ্ল্যামেটরি সংকেতপথ চিহ্নিত হয়েছে। সুতরাং, প্রদাহজনিত হাইপোথ্যালামাসের শারীরবৃত্তীয় পরিবর্তন সৃষ্টি করে ইনসুলিন প্রতিবন্ধকতা এবং গ্লুকোজ অসহিষ্ণুতা। তবে, IKK-β জিনের প্রকাশকে দমন করা হলে দেখা গেছে তা শুধুমাত্র হাইপোথ্যালামিক নিউরনের প্রদাহকেই দমন করে না, বরং অতিভোজন এবং স্থূলতা বা ডায়াবেটিস রোগ হওয়া থেকেও বিরত রাখে।
উপসংহার
প্লাজমা গ্লুকোজের মাত্রা নিয়ন্ত্রণ হলো একটি জটিল এবং বহুমুখী প্রক্রিয়া, যার মধ্যে নানা রিসেপ্টর-প্রোটিন ও স্নায়বিক সঙ্কেতপথ, যা অন্ত্র-মস্তিষ্কের অক্ষ (gut–brain axis)কে সংযুক্ত ক’রে আহার-গ্রহণ (Cifuentes L, Acosta A, 2022) এবং শক্তি ও গ্লুকোজ-সাম্যাবস্থা নিশ্চিত করতে সমন্বিতভাবে কাজ করে (Wachsmuth et., 2022)। অর্থাৎ, দেহে গ্লুকোজ সাম্যাবস্থার জন্য অন্ত্ৰীয় ও অন্তঃক্ষরা সঙ্কেতগুলির মিথস্ক্রিয়া মস্তিষ্কের হাইপোথ্যালামাসে পৌঁছানো গুরুত্বপূর্ণ। এর ব্যত্যয় ঘটলে দেখা দিতে পারে টাইপ ২ ডায়াবেটিস-সহ অন্যান্য রোগ। বর্তমানে, ডায়াবেটিস নিয়ন্ত্রণে জিএলপি-১ ও জিআইপি উভয় হরমোন-ই ডায়াবেটিস চিকিৎসার জন্য বিবেচিত হয়েছে (Mayendraraj et al., 2022)। রক্ত সঞ্চালনে ইন্সুলিন কর্তৃক গ্লুকোজের মাত্রা নিয়ন্ত্রণের জন্য প্রাকৃতিক জিএলপি-১-এর মতো বেশ কিছু ‘জিএলপি-১ রিসেপ্টর অ্যাগনিস্ট’ ওষুধ হিসেবে বাজারজাত করা হয়েছে, যেমন Semaglutide (Ozempic-Novo Nordisk), Dulaglutide (Trulicity-Eli Lilly) ইত্যাদি, যা টাইপ-২ ডায়াবেটিস ও স্থূলতা নিয়ন্ত্রণে ব্যবহৃত হয়। সম্প্রতি, বাংলাদেশেও এটি বাজারজাত করা হয়েছে। এছাড়া, ডায়াবেটিস ও স্থূলতা নিয়ন্ত্রণে আরও একটি ওষুধ Tirzepatide (Zepbound: Eli Lilly) যুক্তরাষ্ট্রের ফুড এন্ড ড্রাগ প্রশাসন (FDA) কর্তৃক সম্প্রতি অনুমোদন পেয়েছে, যথাক্রমে ২০২২ সালের মে মাসে ও ২০২৩ সালের নভেম্বর মাসে। এটি জিআইপি ও জিএলপি-১ উভয় রিসেপ্টরের অ্যাগনিস্ট হিসেবে কাজ করে। প্রাকৃতিক জিআইপি/জিএলপি-১-এর থেকে এই অ্যাগোনিস্টগুলি রাসায়নিকভাবে কিছুটা ভিন্ন, যাতে ওষুধগুলি DPP4 এনজাইম থেকে সুরক্ষিত থাকে, এবং এদের অবস্থান দীর্ঘস্থায়ী হয়। EEC-নিঃসৃত হরমোন যেমন জিআইপি, জিএলপি-১ ও CCK ছাড়াও, বিপাকীয় হার নিয়ন্ত্রণ এবং গ্লুকোজ হোমিওস্টেসিস নিয়ন্ত্রণে মস্তিষ্কের রেনিন-এনজিওটেনসিন সিস্টেমের সম্ভাব্য ভূমিকা রয়েছে, যা এই প্রবন্ধে আলোচিত হয়নি।
References:
- Andermann ML, Lowell BB. Toward a Wiring Diagram Understanding of Appetite Control. Neuron. 2017 Aug 16;95(4):757-778.
- Brady MJ. IRS2 takes center stage in the development of type 2 diabetes. J Clin Invest. 2004 Oct;114(7):886-8.
- Chaudhri OB, Salem V, Murphy KG, Bloom SR. Gastrointestinal satiety signals. Annu Rev Physiol. 2008;70:239-55.
- Cifuentes L, Acosta A. Homeostatic regulation of food intake. Clin Res Hepatol Gastroenterol. 2022 Feb;46(2):101794.
- Fukuda M. The role of GIP receptor in the CNS for the pathogenesis of obesity. Diabetes. (2021) 70(9):1929–37.
- Jastreboff AM, Aronne LJ, Ahmad NN, Wharton S, Connery L, Alves B, Kiyosue A, Zhang S, Liu B, Bunck MC, Stefanski A; SURMOUNT-1 Investigators. Tirzepatide Once Weekly for the Treatment of Obesity. N Engl J Med. 2022 Jul 21; 387(3):205-216.
- Lam CKL, Chari M, Lam TKT. CNS regulation of glucose homeostasis. Physiol. (Bethesda) 2009;24:159–170.
- Mayendraraj A, Rosenkilde MM, Gasbjerg LS. GLP-1 and GIP receptor signaling in beta cells – A review of receptor interactions and co-stimulation. Peptides. 2022 May;151:170749.
- Roder PV, Wu B, Liu Y, Han W (2016) Pancreatic regulation of glucose homeostasis. Exp Mol Med 48:e219.
- Routh VH (2010) Glucose sensing neurons in the ventromedial hypothalamus. Sensors 10(10):9002–9025.
- Schwartz MW, Woods SC, Porte D Jr, Seeley RJ, Baskin DG (2000) Central nervous system control of food intake. Nature 404(6778):661–671.
- Tao R, Copps KD, White MF, Stöhr O. Deletion of Insulin Receptor Substrate 2 in AGRP Neurons Causes Beta-Cell Dysfunction. Diabetes 1 June 2019; 68 (Supplement_1): 1835–P.
- Travagli RA and Anselmi L. Vagal neurocircuitry and its influence on gastric motility. Nat Rev Gastroenterol Hepatol 13(7): 389-401, 2016.
- Wachsmuth HR, Weninger SN, Duca FA. Role of the gut-brain axis in energy and glucose metabolism. Exp Mol Med. 2022 Apr;54(4):377-392.
- Withers DJ, Gutierrez JS, Towery H, Burks DJ, et al. Disruption of IRS-2 causes type 2 diabetes in mice. Nature. 1998 Feb 26;391(6670):900-4.
- Yang D, Hou X, Yang G, Li M, et al. Effects of the POMC System on Glucose Homeostasis and Potential Therapeutic Targets for Obesity and Diabetes. Diabetes Metab Syndr Obes. 2022 Sep 25;15:2939-2950.